Dictamen de comité de ética en investigación
Natacha Salomé Lima
Introducción
Un mayor conocimiento de la genética, y el desarrollo y consolidación de las tecnologías disponibles en los laboratorios de embriología y genética molecular, han contribuido a convertir los estudios genéticos preimplantatorios en una práctica habitual. Recientemente, se presentó al comité de ética una consulta acerca de la inclusión de una nueva técnica de evaluación preimplantatoria destinada a la detección del riesgo de condiciones poligénicas (PGT-P) (Treff et al., 2020).
El análisis del comité de ética partió de considerar, de un modo interdisciplinario y sistemático, la revisión de la literatura disponible sobre el tema y el intercambio con distintos profesionales de la institución. A continuación, se consideran los aspectos más relevantes del intercambio; luego se analizan los principios y valores bioéticos en juego; se resumen los argumentos a favor y en contra presentes en la literatura y, por último, se concluye con el dictamen.
Key points
En la presentación realizada por el Dr. Menazzi se señaló que una de las principales críticas a los estudios de patología poligénica es la “heredabilidad faltante”[2] [missing heritability] (Golan, Lander & Rosset, 2014). Muchas patologías comunes como la diabetes, la hipertensión, la enfermedad coronaria, o la esquizofrenia presentan un componente genético que ha sido demostrado a partir de estudios en gemelos. Sin embargo, aun en gemelos idénticos, el componente hereditario para determinar una enfermedad multifactorial varía en función de la incidencia del ambiente. Para algunas patologías, especialmente las metabólicas, el componente ambiental juega un rol central e incluso mayor al de la predisposición genética.
La noción de “missing heritability” refiere a que los estudios de riesgo poligénico no llegan nunca a identificar el 100% de esa heredabilidad. Lo más probable es que los marcadores conocidos al día de hoy detecten un porcentaje bastante menor (alrededor del 30% a 40%) de esa heredabilidad total. La primera pregunta que surge de este hecho es: ¿es válido afirmar que un embrión va tener mayor riesgo de diabetes que otro, cuando no se conocen el 100% de todos los marcadores para esa condición?
Otro argumento de peso que requiere ser analizado es el de los orígenes étnicos de los individuos que fueron estudiados en los biobancos que sirven de referencia y parámetro para la medición del riesgo que ofrece el test. Muchos de los marcadores de predisposición que hoy se conocen, no son equivalentes para los distintos grupos étnicos. Un mismo marcador genético que otorga predisposición a la diabetes, por ejemplo, en un grupo étnico, puede conferir protección contra la diabetes si se analiza en una población distinta. Actualmente, los estudios de riesgo poligénico ofertados validan sus resultados en biobancos con población distinta a la latinoamericana.
El tercer punto a considerar es la forma de ponderar los antecedentes familiares positivos. Se invoca que, uno de los beneficios de las evaluaciones de riesgo poligénico es conocer el porcentaje de riesgo de un embrión infiriendo que, si existe un hermano que, por ejemplo, sufre una condición particular (para el caso diabetes tipo 1) este tendría un riesgo más alto. Sin embargo, determinar el riesgo de un embrión sin conocer el riesgo del hermano enfermo no reduce el riesgo para ese embrión porque el análisis ha partido de una inferencia, cuando en realidad primero habría que conocer el riesgo poligénico del individuo afectado.
Para todas las condiciones en las que se evalúa la predisposición a determinado riesgo genético el ambiente juega un rol central. Poder anticiparse a conocer determinado riesgo, por ejemplo, mayor riesgo de diabetes, no alteraría la indicación médica profesional de desarrollar una vida lo más saludable posible, y sí podría aumentar las ansiedades parentales en torno al cuidado que podría requerir en el futuro el/a niño/a proyectado/a, a partir del análisis del riesgo del embrión actual.
Figura 1: Ejemplo de reporte de PGT-P para un embrión femenino
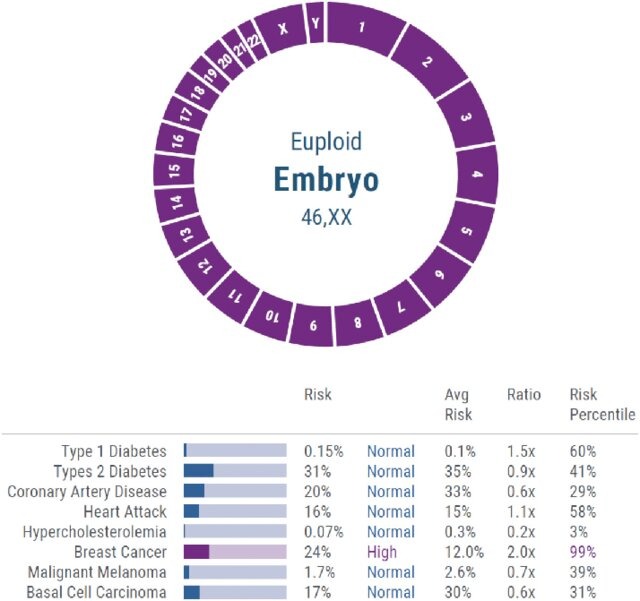
Fuente: publicado en Treff et al., 2020.
Consideraciones éticas
El modelo de equilibrio reflexivo basado en el análisis de los principios bioéticos tradicionales —autonomía, justicia, no maleficencia y beneficencia— suele contraponer una perspectiva liberal de la autonomía personal, primando el derecho a decidir luego de haber sido informado acerca de las técnicas y procedimientos disponibles. La expresión más lograda de esta perspectiva utilitarista, ha sido formulada en el principio de beneficencia procreativa (Savulescu, 2001) el cual establece que los padres tienen la obligación moral de elegir al mejor embrión disponible.
Se sintetizan en el próximo apartado las críticas que, desde la literatura, se esgrimen al enfoque liberal de la autonomía, sobre todo aquellas que resaltan el reduccionismo genético al que se incurre cuando se correlaciona la expresión genotípica con un fenotipo determinado, sin tener en cuenta la incidencia del ambiente para el riesgo que se desea evitar.
La American Society for Reproductive Medicine (ASRM, 2018) ha considerado que, conocer en un embrión una condición que podría desarrollarse después de la primera infancia es una práctica ética adecuada, aun cuando presente una expresividad variable. Sin embargo, anticiparse a ese conocimiento a partir de conocer una predisposición o determinado riesgo en la evaluación genética del embrión in vitro, para patologías de aparición tardía, requiere el asesoramiento genético y psicológico.
Pros y contras: revisión sistemática
ARGUMENTOS A FAVOR | ARGUMENTOS EN CONTRA |
Las personas con infertilidad pueden presentar mayor riesgo de enfermedades cardíacas, cáncer y diabetes; informar a los pacientes de fertilización in vitro (FIV) de la existencia de un test para reducir el riesgo para su descendencia a través de PGT-P es un imperativo ético. | A diferencia de la presencia de una sola variante patogénica que da como resultado el desarrollo de un trastorno causado por un único gen (monogénico), una sola variante genómica no es informativa para predecir el riesgo de enfermedad en una condición poligénica y multifactorial. |
Respetar la libertad reproductiva a partir de informar todas las opciones de tratamiento disponibles. | Debido a la pleiotropía, los embriones seleccionados por un rasgo deseable, pueden tener también un puntaje poligénico inusualmente alto para un rasgo indeseable lo que dificulta la utilidad de la información proporcionada a los futuros padres. |
Si bien el costo del acceso a estas tecnologías es elevado y no está contemplado en la ley de cobertura[3], cuando se alcance una representación más precisa de los datos, se verán los beneficios que, a largo plazo tendrá el haber ofrecido test genéticos preimplantatorios. | La evaluación del riesgo poligénico busca conocer el efecto genómico en el desarrollo de enfermedades específicas y no tiene en cuenta la miríada de factores ambientales que son críticos tanto para el desarrollo como para la prevención de la condición que se quiere evitar. |
Si se considera que haber nacido es un beneficio, se puede considerar que es un beneficio también haber nacido con un riesgo menor de contraer enfermedades prevalentes o comunes. | La evaluación del riesgo poligénico en el contexto reproductivo no presenta una utilidad clínica clara. La precisión de los resultados no puede ser comprobada hasta décadas después del nacimiento. |
Aumento de las ansiedades parentales cuando la decisión se dirime entre transferir un embrión con un riesgo conocido o no tener transferencia. | |
El énfasis excesivo en las condiciones genéticas del proceso salud-enfermedad pone el foco en el individuo y desatiende los determinantes sociales, políticos y culturales y la importancia de las soluciones colectivas. | |
Los test genéticos ofrecidos para adultos no deberían ser trasladados al uso en embriones, fetos o niños/as. |
Consideraciones ético-clínicas y subjetivas
Las condiciones psicofísicas de un ser humano no son ontológicas, es decir no se producen a partir de un ser ya definido naturalmente (sea genético, o basado en determinadas características anatómicas). Tampoco es el resultado performativo de un discurso del entorno (sea este familiar o social). ¿Cuáles son entonces las variables que definen las características, posibilidades y potencias de un ser humano? A cada quien le toca un determinado cuerpo real, con sus potencias y limitaciones, pero no por ello está destinado a identificarse a ese real: aún resta que el sujeto responda respecto de ese cuerpo.
Debemos preguntarnos ¿cuál es entonces el lugar del dato genético? Se trata de un enigma que permanece más allá de cualquier pretensión de certeza. Existiendo la oferta de un test genético preimplantatorio, resulta imposible sustraerse al anhelo de conocer sus resultados. Este rasgo estructural de la curiosidad humana y la necesidad de reaseguramiento, requiere ser acotado. No cercenado, pero sí acotado, en el sentido de suplementar esa demanda con un espacio en el cual tramitar los interrogantes de la persona o pareja parental.
Ocurre que, desde el punto de vista subjetivo, el PGT-P introduce una situación paradojal. La ciencia ofrece un recurso que, de no ser utilizado, genera potencial sentimiento de culpa en los progenitores —por no haber hecho todo lo posible para las mejores condiciones de su descendencia. Pero que si es utilizado introduce la exigencia de tener que decidir respecto de opciones imposibles, reintroduciendo la culpa por no elegir de manera correcta.
Es aquí cuando entra en escena el llamado “asesoramiento genético”, pensado como un recurso de información y decisión (WHO, 2018), pero también para enfrentar la ansiedad que emana de una situación compleja. Confrontarse con percentiles de riesgo cardíaco, cáncer de próstata y/o diabetes tipo 2 (por tomar los ejemplos de la tabla 1), puede ser un factor de angustia. Pero también puede dar lugar a un espacio de escucha y reflexión en el cual indagar las escenas temidas por la persona o pareja parental. Al dar entrada a estos fantasmas, permite tramitar la ansiedad y, cualquiera sea la decisión, convivir mejor con ella. Y prepararse mejor para la saludable incertidumbre sobre el hijo o hija por venir.
Psicológicamente, resulta también importante que la persona o pareja parental cuente con toda la información sobre los alcances y límites de estos estudios, introduciendo la distinción entre probabilidad, predisposición, y presencia o no de potenciales enfermedades, de modo de que, en su fantasía, no conviertan a los test genéticos en una suerte de oráculo del hijo o hija por venir.
Dictamen
Resumiendo, cuando se considere ofrecer el PGT-P, se debería informar acerca de:
- La incerteza que supone la variabilidad del componente hereditario (missing heritability) y el rol del ambiente para las condiciones que se desea evaluar;
- Los marcadores de predisposición conocidos han validado sus datos en biobancos cuyos individuos pertenecen a un origen étnico diferente del latinoamericano;
- La conveniencia de realizar previamente el estudio en la persona afectada, identificando el antecedente que se quiere reducir a través del estudio de los embriones;
- Los resultados que podría arrojar el PGT-P podrían tener poca utilidad clínica y aumentar las ansiedades parentales.
- La importancia de entrevistas con profesionales de la psicología, capacitados en counselling genético, para disponer de un espacio de escucha y reflexión en el cual indagar las expectativas, deseos y escenas temidas por la persona o pareja parental.
Referencias
Ethics Committee of the American Society for Reproductive Medicine (2018). Use of preimplantation genetic testing for monogenic defects (PGT-M) for adult-onset conditions: an Ethics Committee opinion. Fertility and sterility, 109(6), 989–992. https://doi.org/10.1016/j.fertnstert.2018.04.003
Golan, D., Lander, E. S. & Rosset, S. (2014). Measuring missing heritability: inferring the contribution of common variants. Proceedings of the National Academy of Sciences of the United States of America, 111(49), E5272–E5281. https://doi.org/10.1073/pnas.1419064111
Savulescu, J. (2001). Procreative beneficence: why we should select the best children. Bioethics; 15, 413–26.
Tealdi, J.C. (2018). Capítulo 8. Informe técnico del Comité de Ética del Hospital de Clínicas Gral. San Martín UBA. En Dilemas éticos y morales en embriones humano. Abordaje interdisciplinario en salud reproductiva. Editorial Ascune.
Treff, N. R., Eccles, J., Marin, D., Messick, E., Lello, L., Gerber, J., Xu, J. & Tellier, L. (2020). Preimplantation Genetic Testing for Polygenic Disease Relative Risk Reduction: Evaluation of Genomic Index Performance in 11,883 Adult Sibling Pairs. Genes, 11(6), 648. https://doi.org/10.3390/genes11060648
- El presente capítulo fue elaborado y discutido en el marco de una consulta recibida por los integrantes del comité de ética de CEGYR: Lima, Natacha Salomé; Fernández, Darío; Nabel, Adán; Sivo, Silvia; Rodríguez Iturburu, Mariana; Fabbro, Mónica; Arribalzaga, Eduardo; Parera Deniz, Francisco; Michel Fariña, Juan Jorge.↵
- Los estudios han podido identificar muchas variantes genéticas comunes asociadas con cientos de enfermedades. Sin embargo, estas variantes comunes explican una proporción baja de heredabilidad, un problema conocido como la “heredabilidad faltante o perdida”.↵
- Ley de acceso a los tratamientos de reproducción asistida 26.862/2013 no contempla la cobertura de la evaluación genética preimplantatoria. Esta limitación ha sido abordada a propósito de una demanda, en el informe técnico del Comité de ética del Hospital de Clínicas (Tealdi, 2018). ↵






